最近有很多公司計劃將口罩出口歐美市場,,那么如何將口罩在歐盟和美國注冊呢?本文給出指引,,供大家參考,!

NO.1
歐盟個人防護(hù)口罩(非醫(yī)療器械)
歐盟個人防護(hù)口罩的歐洲標(biāo)準(zhǔn)是EN149,按照標(biāo)準(zhǔn)將口罩分為FFP1/FFP2/FFP3三個類別,,需要滿足歐盟(EU)2016/425個人防護(hù)設(shè)備指令(PPE)的要求,。主流的防護(hù)口罩為FFP2/FFP3兩類。
認(rèn)證流程:
1. 產(chǎn)品的型式試驗報告
2. 技術(shù)文件評審
3. 工廠質(zhì)量體系審查
4. 頒發(fā)CE證書
5. 產(chǎn)品出口
注意:必須選擇有PPE發(fā)證能力的發(fā)證機(jī)構(gòu)申請,,發(fā)證機(jī)構(gòu)通過評審EN149報告后頒發(fā)CE-PPE證書,。
NO.2
歐盟醫(yī)用口罩(醫(yī)療器械)
醫(yī)用口罩的歐洲標(biāo)準(zhǔn)是EN14683,按照標(biāo)準(zhǔn)將醫(yī)用口罩分為TYPE Ia/TYPE II/TYPE IIR三個類別,。Type Ia用于流行病期間的患者和其它人群,,Type II和Type IIR用于醫(yī)護(hù)人員。需要滿足歐盟(EU)2017/745(新版醫(yī)療器械MDR)的要求,??谡衷跉W盟屬于I類器械,但是分為I類非無菌和無菌兩種,。

1.非無菌口罩(現(xiàn)階段只有這種可行)
1)編制技術(shù)文件
2)提供測試報告(例如熔噴布性能測試報告和無紡布的生物學(xué)報告)
3)提供符合性聲明
4)指定歐盟授權(quán)代表完成歐洲注冊
時間估計:2-3個月
2.無菌口罩(現(xiàn)階段新版MDR實施難度很大)
1)滅菌確認(rèn)
2)ISO13485體系認(rèn)證
3)編制技術(shù)文件
4)提供測試報告(生物學(xué),、性能、無菌等測試報告)
5)公告機(jī)構(gòu)審核(目前幾乎沒有公告機(jī)構(gòu)愿意接單)
6)獲得CE證書
7)指定歐盟授權(quán)代表完成歐洲注冊
時間估計:1-2年,,因此今年幾乎是不可能了!
檢測標(biāo)準(zhǔn)
1)生物學(xué)評價:ISO10993-1,,-5,,-10(常規(guī)三項)
2)細(xì)菌過濾效率:EN 14683:2019附錄B
3)呼吸阻抗:EN 14683:2019的附錄C
4)防濺阻力:ISO 22609:2004
5)生物負(fù)載:EN ISO 11737-1:2018、EN 14683:2019附錄D(同一批次檢測數(shù)量不少于5個)

NO.3
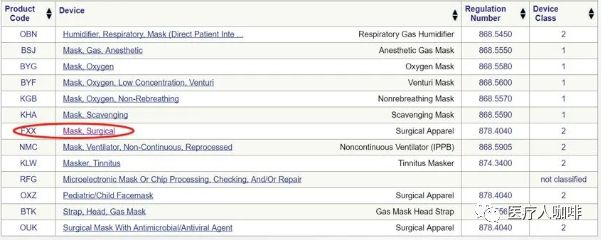
美國FDA注冊醫(yī)用口罩
常見的醫(yī)用口罩在美國FDA屬于II類醫(yī)療器械,,產(chǎn)品代碼為FXX,,規(guī)則號878.4040。除此之外還有OXZ兒科口罩和OUK帶抗菌/抗病毒介質(zhì)的外科口罩,。一般來說選擇FXX類型的口罩,。
510k申請流程:
1)進(jìn)行產(chǎn)品測試(性能測試,、生物學(xué)測試)
2)準(zhǔn)備510k技術(shù)文件,提交FDA審評
3)獲得FDA的510k批準(zhǔn)信
4)完成工廠注冊和器械列名
時間估計:6-10個月
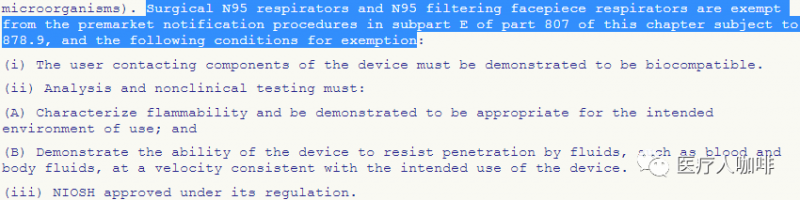
注意:如已從官方途徑獲得N95認(rèn)證并通過生物學(xué),、阻燃和血液穿透測試可豁免510k
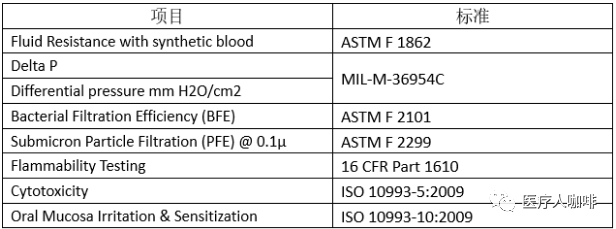
口罩檢測必須滿足ASTM的標(biāo)準(zhǔn),,如下:
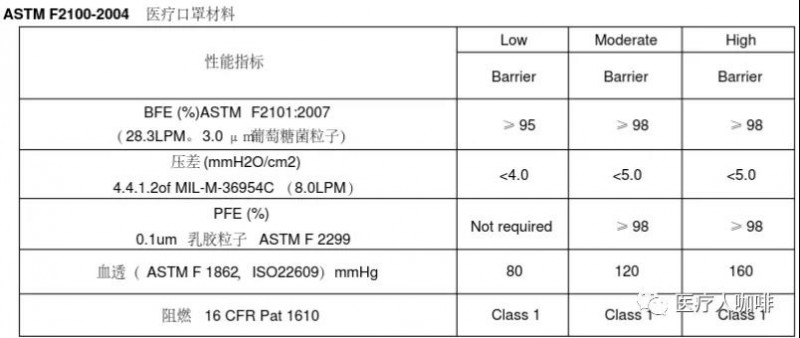
NO.4
美國NIOSH認(rèn)證防護(hù)口罩
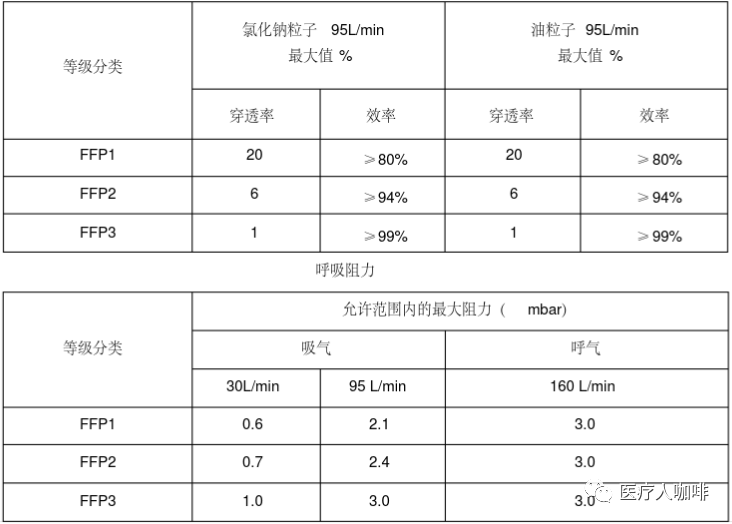
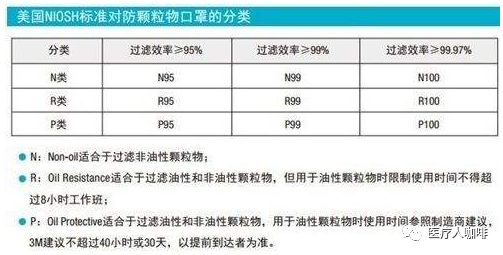
防護(hù)口罩需要獲得NIOSH(美國國家職業(yè)安全衛(wèi)生研究所)認(rèn)證。按照過濾效率個人防護(hù)口罩可分成N95,、N99,、N100、R95,、R99,、R100、P95,、P99,、P100共9個類別。
按過濾網(wǎng)材質(zhì)的最低過濾效率,,可將口罩分為三種等級:N ,R ,P
N類的口罩只能過濾非油性顆粒物,,比如:粉塵、酸霧,、漆霧,、微生物等??諝馕廴局械膽腋∥⒘?,也多是非油性的。
R類的口罩只適合過濾油性顆粒物及非油性顆粒物,,但用于油性顆粒物時限制使用時間不得超過8小時,。
P類的口罩則既可過濾非油性顆粒物,又可過濾油性顆粒物,。油性顆粒物比如:油煙,、油霧等。
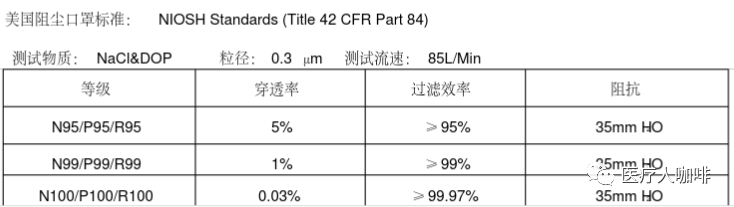
NIOSH認(rèn)證系列口罩需符合42 CFR Part 84的要求,,測試指標(biāo)包括呼氣阻力測試(Exhalation Resistance Test),、呼氣閥泄漏測試(Exhalation Valve Leakage Test)、吸氣阻力測試(Inhalation Resistance Test),、過濾效率測試(Sodium Chloride Test)等,。
認(rèn)證的申請需按照NIOSH的指南實施,企業(yè)需寄送樣品至NIOSH實驗室實施測試,,同時提交技術(shù)性資料(包括質(zhì)量體系資料)至NIOSH進(jìn)行文件審核,,只有文件審核和產(chǎn)品測試都通過,NIOSH才會核發(fā)認(rèn)證,。具體的認(rèn)證則由NIOSH下屬的NPPTL 實驗室操作,。
時間估計:2-3個月

























 602030鋰電池300毫安3.7...
602030鋰電池300毫安3.7... 















 京公網(wǎng)安備 11011202001879號
京公網(wǎng)安備 11011202001879號